

盡管在2021年12月歐盟發(fā)布公告IVDR實(shí)施日期延期,但是對(duì)于A類產(chǎn)品,仍必須在2022年5月26日之前以Self-declaration符合(EU)2017/746才可進(jìn)入歐盟市場(chǎng),A類產(chǎn)品歐盟注冊(cè)迫在眉睫。
IVDR新法規(guī)增加了很多全新的要求,包括產(chǎn)品分類,唯一器械標(biāo)識(shí)(UDI),CE相關(guān)認(rèn)證方(制造商、歐盟授權(quán)代表、經(jīng)銷商等)在歐盟注冊(cè)要求,性能評(píng)估及上市性能跟蹤要求,上市后市場(chǎng)監(jiān)督要求等。對(duì)于生產(chǎn)商來說,提高了歐盟市場(chǎng)的準(zhǔn)入門檻,并且對(duì)其監(jiān)管更加嚴(yán)格,給制造商帶來極大的挑戰(zhàn)。
明德生物緊鑼密鼓地開展了法規(guī)跟蹤與實(shí)施工作,按照IVDR法規(guī)要求,完善產(chǎn)品性能,完成產(chǎn)品技術(shù)文檔及體系升級(jí),4款產(chǎn)品:Disposable virus sampling tube (一次性病毒采樣管),Sample release Reagent(樣本釋放劑),F(xiàn)ull-Automatic Nucleic acid Extraction and Purification Instrument (全自動(dòng)核酸提取純化儀)及Nucleic Acid (DNA/RNA) Extraction Kit(核酸提取試劑)已于2022年3月18日通過了歐盟IVDR注冊(cè)。 附注冊(cè)確認(rèn)部分截圖: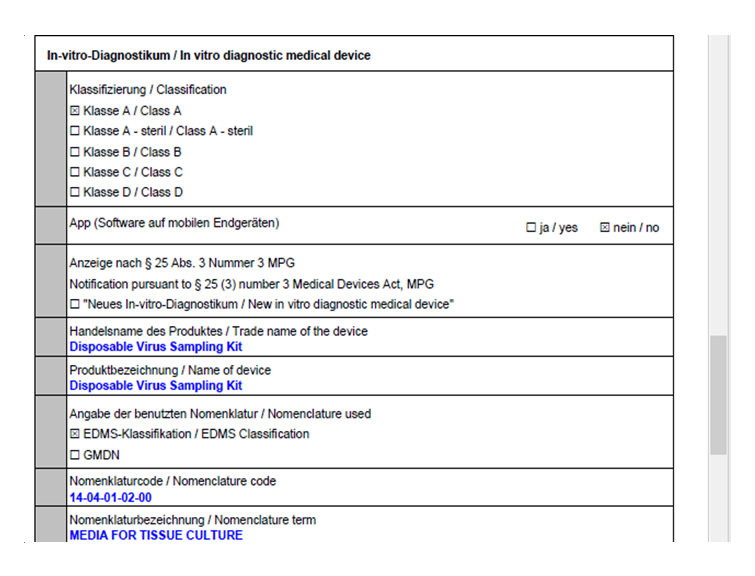
TEL:027-86507708

Copyright © 2024 武漢明德生物科技股份有限公司版權(quán) | 鄂ICP備12000100
互聯(lián)網(wǎng)藥品信息服務(wù)資格證書 [(鄂)-非經(jīng)營(yíng)性-2016-0005]
 鄂公網(wǎng)安備 42011502000634
鄂公網(wǎng)安備 42011502000634
